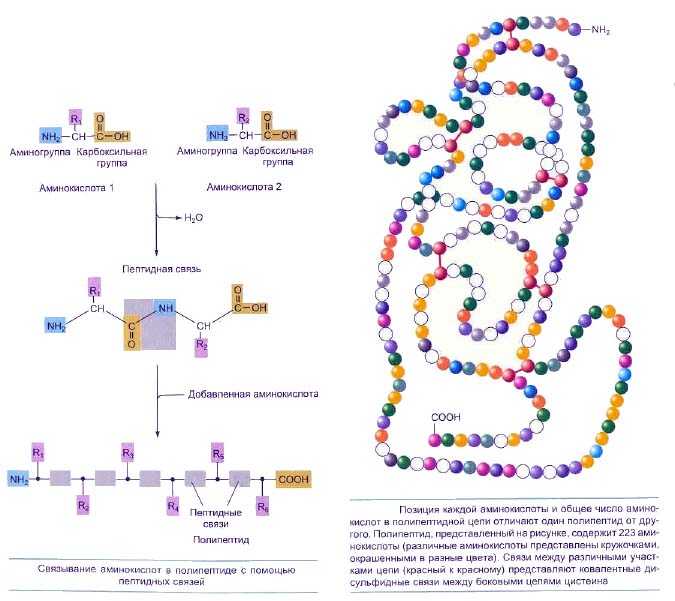
В молекулах белка остатки аминокислот, расположенные последовательно, соединяются ковалентно друг с другом. Благодаря этому образуются длинные неразветвленные полимерные цепи. Аминокислоты в цепи располагаются таким образом, что аминогруппа одной аминокислоты взаимодействует с карбоксильной группой другой. При этом взаимодействии выделяется молекула воды и между двумя группами образуется пептидная связь. Такое соединение назвали пептидом. Соответственно, пептид, который состоит из двух аминокислот, называют дипептидом, из трех -трипептидом. Таких аминокислотных остатков в молекулах белка может содержаться сотни или даже тысячи. Т. е., белки — это полипептиды. Необходимо отметить, что молекулы белка не беспорядочно построенные полимеры разной длины, каждая молекула характеризуется определенной последовательностью аминокислот, и эта последовательность определяется структурой гена, который кодирует данный белок.
Первичная структура или формула молекулы белка определяется последовательностью аминокислотных остатков. Практически неограниченное количество белков может быть создано с помощью 20 аминокислот. Эти белки могут различаться и по количеству входящих в их состав аминокислот, и по их последовательности. Это можно сравнить с алфавитом. Когда из двух — трех десятков букв создается огромное число слов. Общее количество различных белков, встречающихся у живых организмов, достигает порядка 1010-1012. Важнейшая задача современной биологии — определение первичной структуры белков и установление зависимости между первичной структурой и их функциональной активностью.
В настоящее время первичную структуру белков определяют с помощью методов генной инженерии по последовательности нуклеотидов в соответствующем гене, т.к. структура гена задается последовательностью аминокислот. В длинной полипептидной цепи допустимо свободное вращение атомов вокруг многих связей, поэтому полипептидная цепь является достаточно гибкой молекулой.
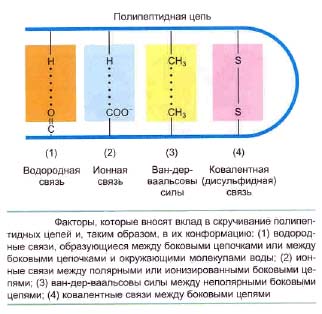
В принципе, белковая молекула может укладываться различными способами, принимая большое число различных форм (конформаций). Однако в клетке большинство белков в нативном (неповрежденном) состоянии существует лишь в одной, характерной для данного полипептида конформации. Она определяется тем фактом, как именно сворачивается полипептидная цепь в растворе, что, в свою очередь, зависит от последовательности аминокислот в этой цепи. Боковые группы аминокислот взаимодействуют друг с другом и с водой, с образованием очень слабых нековалентных связей. Однако часть боковых цепей, расположенных в ключевых местах цепи, образует более сильные связи, что делает конформацию белка достаточно стабильной.
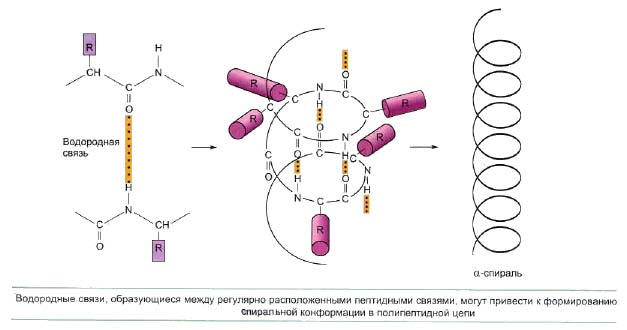
Полипептидные цепи большинства белков сворачиваются самопроизвольно или с участием специальных белков шаперонов (см. ниже), формируя нужную конформацию. Если у различных белков сравнить пространственные структуры, можно заметить, что хотя каждый белок имеет уникальную конформацию, несколько способов укладки постоянно повторяются в различных частях белковых молекул. Наиболее часто можно встретить два способа укладки, которые стабилизируются регулярными водородными связями, образующимися между самими пептидными группами. Отдельные участки полипептидной цепи чаще всего сворачиваются в спираль (альфа-спираль) либо образуют зигзагообразные структуры, называемые бета-складчатым слоем или бета-структурой.
Спиральная структура формируется при закручивании полипептидной цепи вокруг себя с образованием жесткого цилиндра и стабилизируется c помощью водородных связей, образуемых между NH-группами, расположенными на одном витке и CO-группами, назодящихся на другом витке спирали. Эти водородные связи направленны параллельны оси спирали. Структура типа складчатого слоя формируется двумя антипараллельными участками цепи и стабилизируется благодаря водородным связям, образуемым между параллельными слоями. С наружной стороны спирали или зигзагообразной структуры располагаются боковые цепи аминокислот. Несмотря на то, что водородные связи слабее ковалентных, благодаря их присутствию в значительных количествах структуры типа альфа-спирали или бета-складчатого слоя оказываются достаточно прочными. Образование на отдельных участках полипептидной цепи альфа-спиралей и бета-структур приводит к формированию вторичной структуры белка.
Структуры типа складчатого слоя и спиральные участки подвергаются дальнейшей упаковке. В результате этого растворимые белки, как правило, образуют глобулярную структуру, имеющую вид клубка. В такой глобуле на поверхности оказываются заряженные аминокислотные остатки, а гидрофобные — внутри клубка. При этом формируется третичная структура белка. бета-складчатые слои часто входят в состав сердцевины многих глобулярных белков. В упакованной в виде глобулы молекуле белка аминокислотные остатки, расположеные в полипептидной цепи далеко друг от друга, сближаются.
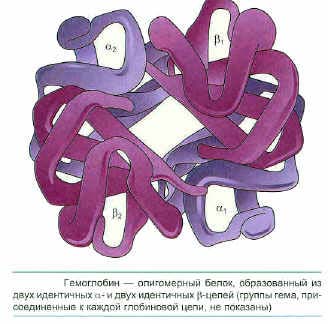
В состав многих белков входят несколько полипептидных цепей, которые могут быть и одинаковой. и разной структуры. Объединение белков становится возможным в том случае, если на поверхности белка образуется центр связывания для того же самого или другого белка. Объединение белковых цепей приводит к образованию сложного белка, для него характерна четвертичная структура. Белки такого типа называются олигомерами, а отдельные полипептидные цепи, входящие в их состав — мономерами. Одним из типичных примеров олигомерного белка является молекула гемоглобина, в состав которой входят две пары цепей. Каждая пара полипептидных цепей в молекуле гемоглобина представлена одинаковыми молекулами (альфа- и бета-глобинами). Многие олигомерные белки в свою очередь являются субъединицами, участвующими в формировании более крупных агрегатов.
Большинство белковых молекул могут сохранять свою биологическую активность, т.е. выполнять свойственные им функции только в узком диапазоне температур и кислотности среды. Если температура повышается или изменяется кислотность до каких-то экстремальных значений, в структуре белков начинаются изменения, называемые денатурацией. В качестве примера денатурации можно привести свертывание белка яйца при варке. При денатурации пептидные связи не разрываются, но разрушается характерная для данного белка структура (четвертичная, третичная и вторичная). В результате этого в состоянии денатурации полипептидные цепи белков образуют случайные и беспорядочные клубки и петли.

 Posted in
Posted in  Tags:
Tags: